近日,国际知名期刊Journal of Advanced Research(中科院一区,IF:13.0)在线发表了西北大学医学院郝晓柯教授团队和澳门科技大学张康教授团队与鹍远生物在前列腺癌无创诊断领域的最新合作研究成果:The significance of urine extracellular vesicle DNA methylation detection in the diagnosis and classification of prostate cancer [1](图1)。该研究首次系统评估了尿液细胞外囊泡(EV)DNA甲基化在前列腺癌诊断与风险分层中的价值,并构建出具有高区分能力的诊断模型,为前列腺癌的早期筛查与精准分型提供了全新的液体活检策略。前列腺癌(PCa)是男性高发恶性肿瘤,临床常用的PSA检测在区分良性前列腺增生(BPH)与恶性肿瘤、鉴别惰性与侵袭性癌方面存在局限,易导致过度诊断或不必要活检[2,3]。因此,开发无创、精准的新型诊断工具成为迫切需求。

图1. 研究成果刊发
【研究方案】
本研究聚焦尿液细胞EV DNA甲基化检测技术。尿液样本具有无创、易获取等优势,且EV由活细胞主动分泌,其DNA稳定性高,能更完整反映源细胞基因组状态,是理想的液体活检靶标。
研究团队系统分析了不同EV DNA的特性,并优化了EV DNA甲基化检测流程,通过全基因组简化甲基化测序(RRBS)筛选前列腺癌特异性甲基化区域,同时整合了TCGA公共数据库及文献标志物,构建了前列腺癌特异性靶向测序组合。进一步利用机器学习,基于尿液EV DNA甲基化数据建立了鉴别良恶性及侵袭性癌的诊断模型,并锁定6个核心标志物进行PCR验证(图2)。
研究共纳入195例样本(86例BPH,109例PCa),设立筛选、测序验证与PCR验证三个独立队列,确保结果稳健可靠。该体系为前列腺癌无创诊断与风险分层提供了新的技术路径。
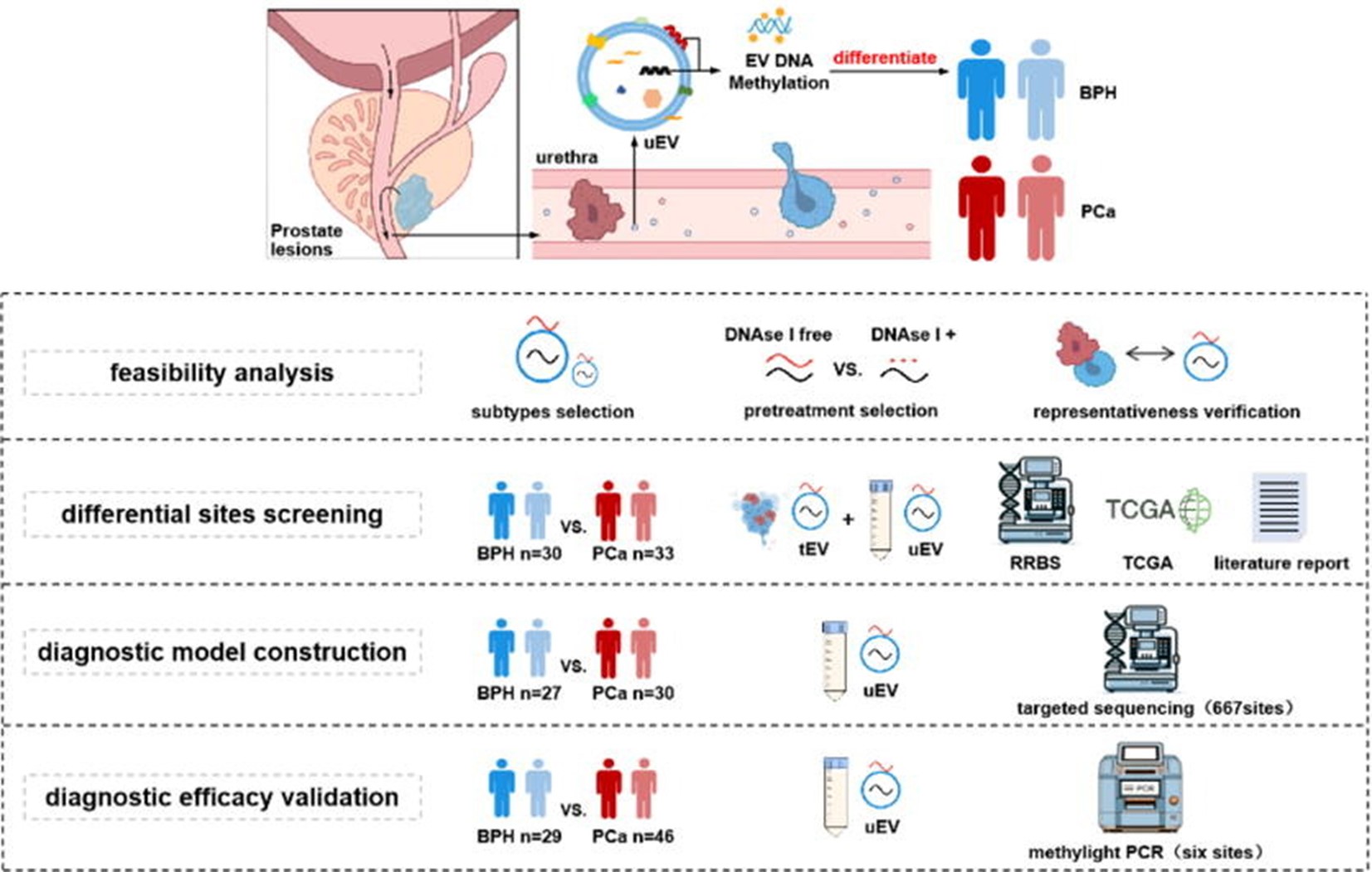
图2. 研究总览
【研究结果】
- 1. 明确尿液EV DNA生物学特性,优选检测策略
研究团队通过多种实验技术,系统分析了尿液来源的大囊泡(lEV)、小囊泡(sEV)及总囊泡(total EV)中DNA的分布、片段大小与甲基化一致性(图3)。发现两类外泌体囊泡(lEV/sEV)均能精准反映来源细胞的基因组 DNA 甲基化状态,且总外泌体囊泡(无需 DNase I 处理)可最大化保留 DNA 信息量(图4),显著简化临床检测流程。这一发现为后续技术开发奠定了关键基础,也更适合进行临床转化。
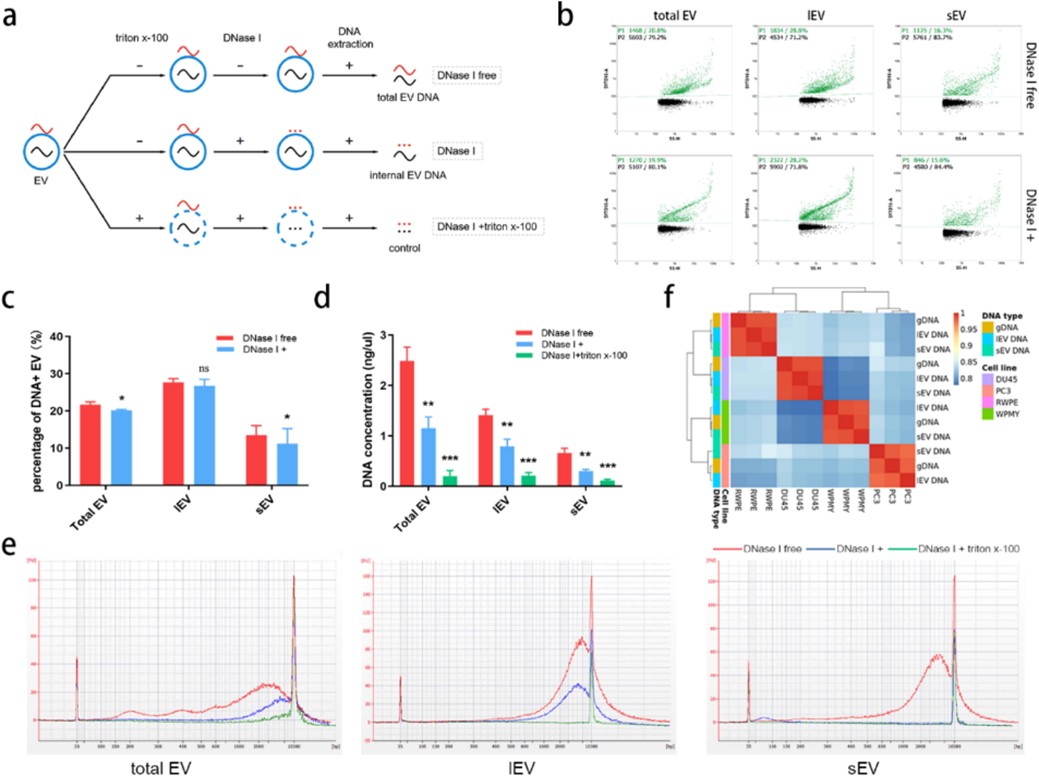
图3. 不同类型EV的生物学特性
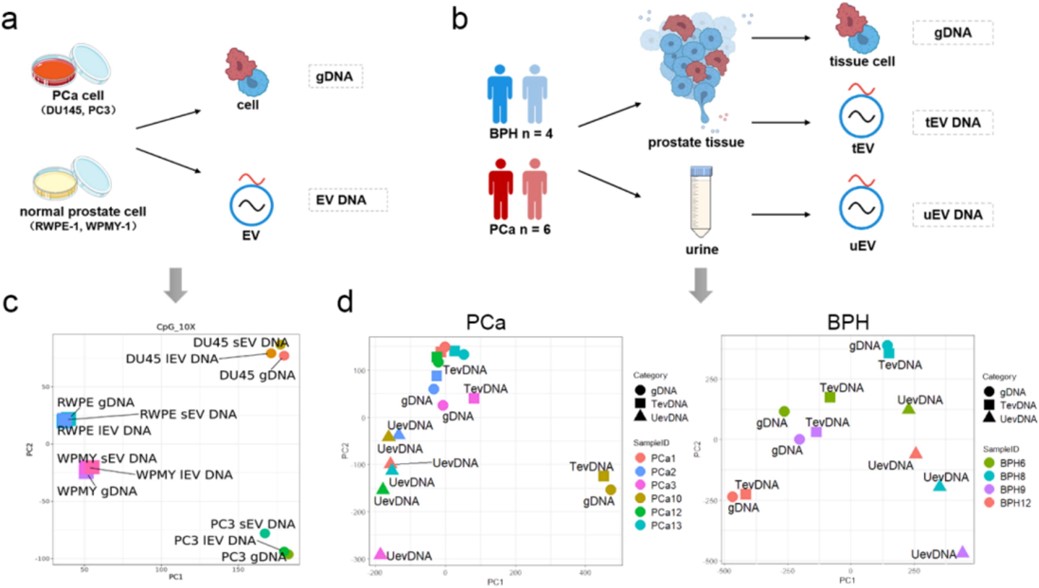
图4. 不同类型EV DNA对基因组DNA的代表性分
- 2. 构建前列腺癌特异性甲基化靶点Panel
研究团队通过对组织EV DNA进行RRBS测序,结合TCGA数据库与文献报道,筛选出667个前列腺癌特异性甲基化靶点,并构建了靶向甲基化测序Panel(图5)。研究团队基于该panel成功构建出区分BPH与PCa的PCa_seek模型(AUC=0.72),结合PSA后AUC提升至0.88(图6)。
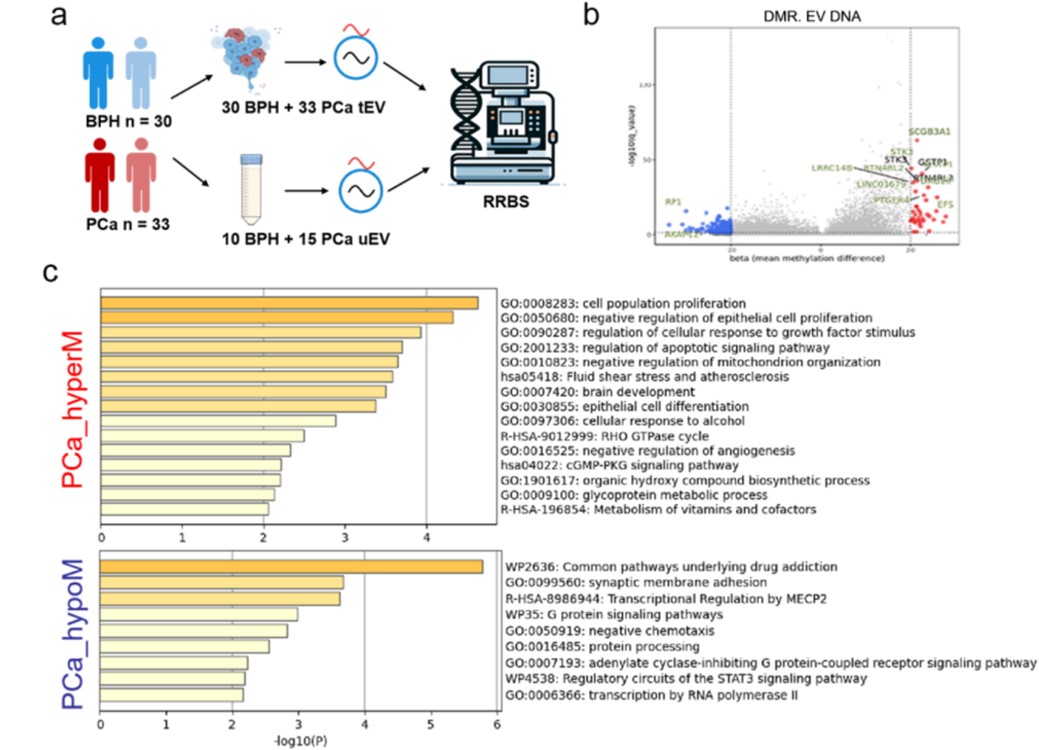
图5. 筛选前列腺癌特异性甲基化标志物
- 3. 首次建立基于尿液EV DNA的侵袭性前列腺癌诊断模型
更具临床意义的是,研究团队构建了proPCa_seek1模型,用于区分惰性前列腺病变与Gleason评分>7的侵袭性前列腺癌,其AUC高达0.93(图6),展现出在识别高危患者方面的独特优势。
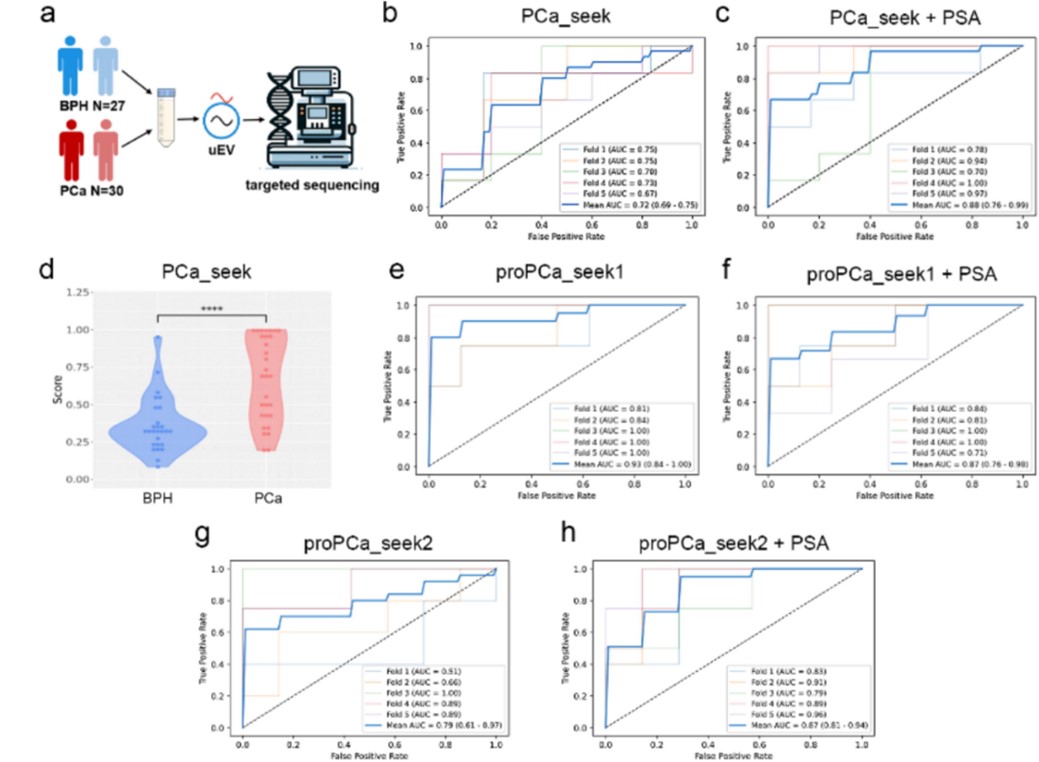
图6. 基于尿液EV DNA NGS panel检测效果
- 4. 锁定6个核心甲基化位点,实现PCR验证
研究进一步锁定6个核心甲基化位点,并采用甲基化PCR在独立验证队列中验证其诊断效能(图7)。结果显示:
6位点联合模型在区分BPH与前列腺癌中AUC为0.71,联合PSA后提升至0.79;
在区分侵袭性前列腺癌方面,6位点模型AUC达0.80,联合PSA后提升至0.88。
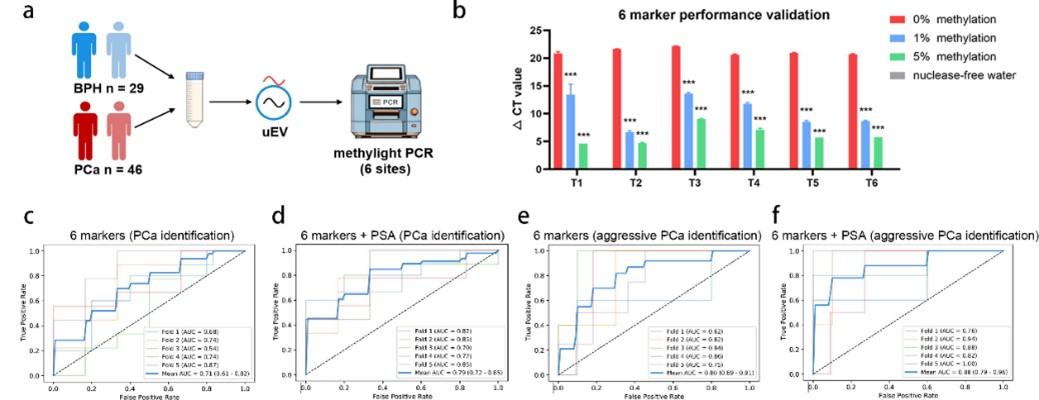
图7. 基于6个尿液EV DNA甲基化PCR marker检测性能验证
【研究结论】
本研究成功开发并验证了一种基于尿液细胞EV DNA甲基化的新型前列腺癌无创诊断方法。研究不仅系统建立了EV DNA甲基化检测的标准化流程,还通过大规模筛选,首次构建了针对前列腺癌,特别是侵袭性前列腺癌的高精度诊断模型。系统证实了尿液EV DNA甲基化在前列腺癌诊断与风险分层中的临床应用价值,为解决PSA筛查的“过度诊断”与“分类不足”问题提供了新的分子工具。
西安交通大学第二附属医院丁汀博士、西京医院刁艳君博士、鹍远生物付睿卿博士和巩成相博士为本文的共同第一作者。西北大学医学院郝晓柯教授和澳门科技大学医学院张康教授为本文共同通讯作者。该研究由国家自然科学基金(8217102695)、陕西省秦创原“科学家+工程师”队伍建设项目(2022KXJ-103)等项目资助。
【关于鹍远生物】
自2014年成立以来,鹍远生物始终以攻克癌症早筛与辅助诊断为目标。作为甲基化检测技术的引领者和推动者,开发了一系列肿瘤分子检测解决方案,提供高发癌症的早期检测、早期诊断、复发预测及复发监测的全周期服务。
鹍远生物拥有丰富的产品管线,覆盖多癌种、结直肠癌、肝癌、胃癌、食管癌、胰腺癌等。2024年5月,其自主研发的常艾克®获得国家药品监督管理局(NMPA)三类医疗器械注册证;2023年5月,胰腺癌早检技术PDACatch获美国食品药品监督管理局(FDA)突破性医疗器械认定;在多癌早检领域,自主研发的消化系统五癌血液多基因甲基化检测技术 GutSeer®已于2024年获欧盟CE认证。公司将继续致力于开发创新可靠的癌症精准检测产品,推动癌症精准医疗领域的发展。
鹍远生物致力于构建开放多元的“产学研医检”协同创新生态,承担了国家级重大科研项目课题,牵头起草了多个重要行业标准,并与国内外顶尖学术机构、医院及药企开展了广泛合作,推动肿瘤早筛及液体活检领域的科学研究、临床实践及应用转化,已成长为全球肿瘤早筛和液体活检领域的领军企业。
【参考文献】
[1] Ding T, Diao Y, Fu R, Gong C, He Q, He W, et al. The significance of urine extracellular vesicle DNA methylation detection in the diagnosis and classification of prostate cancer. J Adv Res. 2025.
[2] Louie KS, Seigneurin A, Cathcart P, Sasieni P. Do prostate cancer risk models improve the predictive accuracy of PSA screening? A meta-analysis. Ann Oncol. 2015;26(5):848-64.
[3] Dushimova Z, Iztleuov Y, Chingayeva G, Shepetov A, Mustapayeva N, Shatkovskaya O, et al. Overdiagnosis and Overtreatment in Prostate Cancer. Diseases. 2025;13(6).
声明:*本文仅供医学专业人士阅读参考,非广告用途。医学界力求其发表内容专业、可靠,但不对内容的准确性做出承诺;请相关各方在采用或以此作为决策依据时另行核查。







